Laju reaksi adalah salah satu bab yang dipelajari dalam mata pelajaran kimia. Pengetahuan tentang laju reaksi memiliki manfaat dalam kehidupan sehari-hari. Simak penjelasan dan contoh laju reaksi di bawah ini.
Dalam e-Modul Kimia kelas XI yang dikeluarkan Kemdikbud RI, dijelaskan bahwa laju reaksi adalah perubahan konsentrasi pereaksi (reaktan) atau konsentrasi hasil reaksi (produk) tiap satuan waktu.
Dalam kehidupan sehari-hari, terdapat contoh reaksi kimia yang berlangsung sangat cepat dan ada yang berlangsung dengan lambat. Seperti ledakan bom yang cepat dan sebaliknya proses korosi benda.
SCROLL TO CONTINUE WITH CONTENT
Kecepatan proses reaksi kimia yang berlangsung inilah yang kemudian dinamakan laju reaksi kimia.
Faktor-faktor Laju Reaksi
Laju reaksi sendiri dipengaruhi oleh 4 faktor yakni:
1. Luas permukaan bidang sentuh
Kecepatan reaksi dipengaruhi oleh ukuran partikel zat. Semakin luas permukaan bidang sentuh zat yang bereaksi akan mempermudah terjadinya tumbukan efektif.
2. Konsentrasi
Laju reaksi akan semakin cepat seiring bertambahnya konsentrasi pereaksi, begitu juga sebaliknya.
3. Kenaikan suhu
Kenaikan suhu mempercepat laju reaksi karena kenaikan suhu menyebabkan gerakan partikel semakin cepat.
4. Katalis
Katalis yang dapat mempercepat laju reaksi disebut katalis positif atau dikenal dengan nama katalisator. Sedangkan katalis yang memperlambat laju reaksi disebut katalis negatif atau dikenal dengan nama inhibitor.
Persamaan Laju Reaksi
Dalam ilmu Kimia, laju reaksi menunjukkan perubahan konsentrasi zat yang terlibat dalam reaksi setiap satuan waktu.
Konsentrasi pereaksi dalam suatu reaksi kimia semakin lama semakin berkurang, sedangkan hasil reaksi semakin lama semakin bertambah.
Perhatikan gambar!
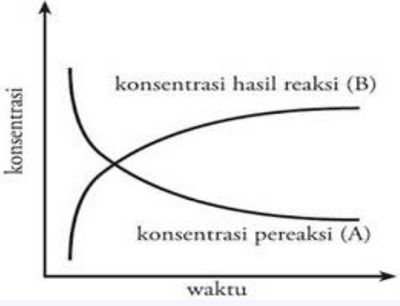 Diagram Laju Reaksi Foto: Sumber: E-Modul Kimia Kelas XI Kemdikbud RI Diagram Laju Reaksi Foto: Sumber: E-Modul Kimia Kelas XI Kemdikbud RI |
Dari diagram diatas reaksi kimia: A → B, maka laju berubahnya zat A menjadi zat B ditentukan oleh jumlah zat A yan bereaksi dan jumlah zat B yan terbentuk tiap satuan waktu.
Pada saat konsentrasi pereaksi zat A berkurang, konsentrasi hasil reaksi zat B bertambah. Dengan demikian konsep laju reaksi kimia untuk reaksi: A → B dapat dirumuskan sebagai berikut :
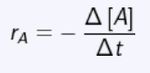 Persamaan Laju Reaksi Kimia I Foto: Sumber: E-Modul Kimia Kelas XI Kemdikbud RI Persamaan Laju Reaksi Kimia I Foto: Sumber: E-Modul Kimia Kelas XI Kemdikbud RI |
Atau
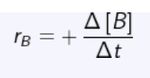 Persamaan Laju Reaksi Kimia II Foto: Sumber: E-Modul Kimia Kelas XI Kemdikbud RI Persamaan Laju Reaksi Kimia II Foto: Sumber: E-Modul Kimia Kelas XI Kemdikbud RI |
Keterangan:
rA = laju reaksi berkurangnya zat A
rB = Laju reaksi bertambahnya zat B
∆c = Perubahan konsentrasi
∆t = perubahan waktu
Contoh Soal Laju Reaksi
Pada reaksi zat A menjadi zat B diketahui bahwa konsentrasi zat A adalah 8 M, setelah 2 detik menjadi 6 M. Tentukan laju reaksinya.
Jawaban:
- Perubahan konsentrasi= ∆c= (8-6)M = 2 M
- Perubahan waktu = ∆t = 2 detik
Laju reaksi dari zat A menjadi Zat B adalah:
v=∆c/∆t
v= 2/2
v = 1 M/detik.
Nah, itulah penjelasan mengenai laju reaksi beserta faktor-faktor yang mempengaruhinya. Selamat belajar detikers!
(faz/pal)

























































