Struktur atom merupakan susunan dari bagian-bagian yang terdapat dalam atom. Teori atom sendiri adalah teori yang digunakan untuk mengenali sifat dari suatu benda.
Berdasarkan sejarah yang tercatat, penemu teori Atom adalah Democritus, seorang yang berasal Yunani. Dalam mempelajari perkembangan atom, kita akan diajak untuk membayangkan, melihat, dan menggambarkan struktur atom.
Teori dan Struktur Atom
Model atom akan menunjukkan struktur atom dan susunan partikel subatom dalam suatu atom.
SCROLL TO CONTINUE WITH CONTENT
Dirangkum dari e-modul Kimia Kemdikbud Kelas X yang disusun oleh Fadillah Okty Myranthika, berikut merupakan perkembangan struktur atom dengan teori atom dari masa ke masa:
1. Model Atom John Dalton (1803)
 Model Atom John Dalton (1803). Foto: Valkurare/Wikimedia Commons Model Atom John Dalton (1803). Foto: Valkurare/Wikimedia Commons |
Dalton merupakan ilmuwan pertama yang mengembangkan model pada tahun 1803-1808. Model atom yang dihipotesiskan Dalton yaitu digambarkan sebagai bola pejal (tolak peluru).
Sayangnya, teori Dalton tidak bisa menjelaskan tentang bagaimana atom sebagai bola pejal bisa menghantarkan arus listrik. Padahal, listrik merupakan elektron yang bergerak.
2. Model Atom JJ Thomson (1904)
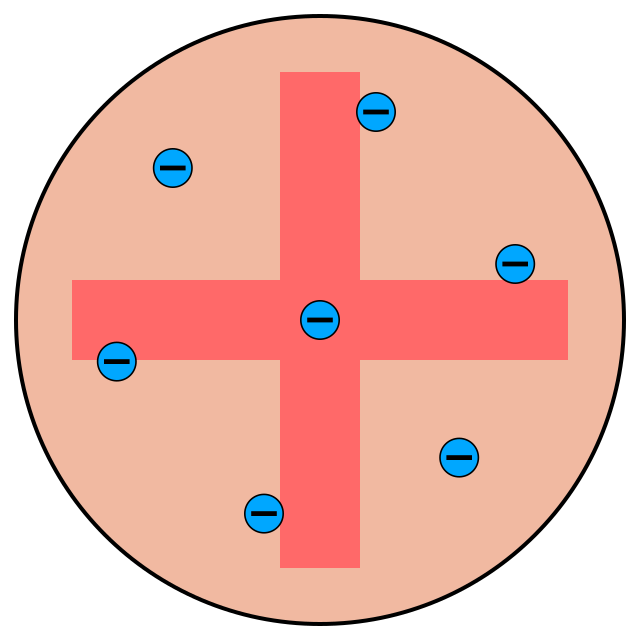 Model Atom JJ Thomson (1904). Foto: Kurzon/Wikimedia Commons Model Atom JJ Thomson (1904). Foto: Kurzon/Wikimedia Commons |
Di awal abad ke 20, Joseph John Thomson menggambarkan atom seperti bola pejal (bola yang bisa bermuatan positif). Pada model atom Thomson permukaannya tersebar elektron yang bermuatan negatif, yang dibuktikan dengan partikel yang bermuatan negatif dalam atom.
Kekurangan teori Thomson yaitu tidak mampu menjelaskan susunan muatan positif dan negatif dalam atom, dan tidak adanya lintasan elektron serta tingkat energi.
3. Model Atom Rutherford (1911)
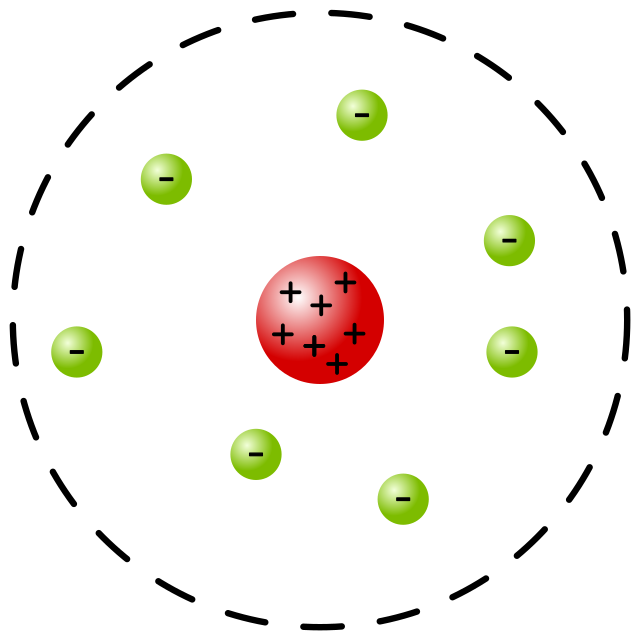 Model Atom Rutherford (1911). Foto: Bensteele1995/Wikimedia Commons Model Atom Rutherford (1911). Foto: Bensteele1995/Wikimedia Commons |
Ahli fisika kelahiran Selandia Baru, Ernest Rutherford, mengembangkan model atom seperti tata surya. Model atom Rutherford adalah bola berongga yang tersusun dari inti atom yang bermuatan positif, dengan elektron yang mengelilinginya.
Massa atomnya terpusat pada inti atom. Model atom Rutherford sama seperti bagaimana planet mengelilingi matahari.
4. Model Atom Niels Bohr (1913)
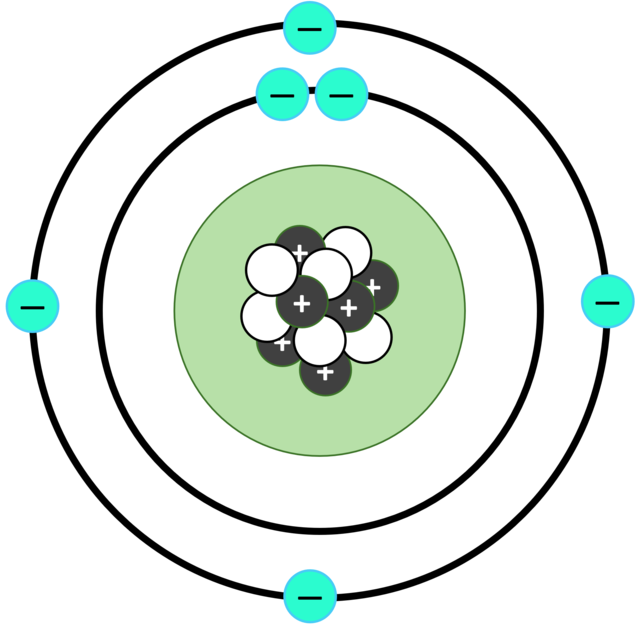 Model Atom Niels Bohr (1913). Foto: SrKellyOP/Wikimedia Commons Model Atom Niels Bohr (1913). Foto: SrKellyOP/Wikimedia Commons |
Tahun 1913 ahli fisika Denmark, Niels Bohr, menjadi ilmuwan pertama yang mengembangkan teori struktur atom. Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif di dalam suatu lintasan.
Dalam model Bohr, elektron dapat berpindah dari satu lintasan ke lintasan yang lain, dengan menyerap energi sehingga energi elektron atom itu tidak akan berkurang. Jika berpindah ke lintasan yang lebih rendah, maka elektron akan memancarkan energi.
Kelemahannya, model Bohr terdapat radius dan orbit. Di mana, hal ini tidak sesuai dengan prinsip ketidakpastian Heisenberg yang menyatakan radius tidak dapat ada bersamaan dengan orbit.
Model ini juga tidak menjelaskan efek zeeman (ketika garis spektrum terbagi, akibat adanya medan magnet).
5. Model Atom E. Schrodinger Mekanika Kuantum (1926)
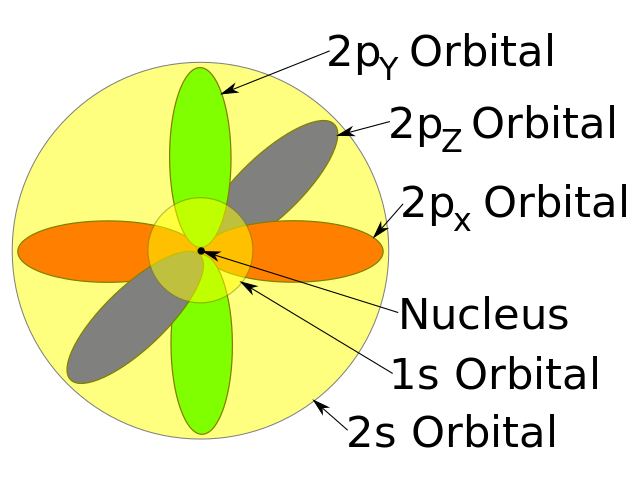 Model Atom E. Schrodinger Mekanika Kuantum (1926). Foto: John Trombley/Wikimedia Commons Model Atom E. Schrodinger Mekanika Kuantum (1926). Foto: John Trombley/Wikimedia Commons |
Pemahaman tentang atom makin modern setelah abad ke 20. Model atom modern inilah yang sekarang kita yakini. Pada 1926, model atom modern telah disempurnakan oleh Erwin Schrodinger.
Model Schrodinger menjelaskan bahwa partikel tak hanya gelombang, melainkan gelombang probabilitas. Kulit-kulit elektronnya tak memiliki kedudukan yang pasti dari suatu elektron.
Sebelumnya, Werner Heisenberg juga mengembangkan teori mekanika kuantum dengan prinsip ketidakpastian.
Awan elektron yang ada sekitar inti atom menunjukkan lokasi kebolehjadian ditemukannya elektron. Hal ini disebut orbital, di mana orbital menggambarkan tingkat energi elektron.
Model atom dengan orbital lintasan elektron merupakan model atom modern, yang disebut juga model atom mekanika kuantum yang berlaku hingga sekarang ini.
Dari pembahasan model atom tadi, model atom JJ Thomson dan Rutherford sudah tidak dipakai lagi.
Dikutip dari buku Belajar Kimia Menarik SMA/MA Kelas X (Diknas) oleh Das Salirawati, dkk., partikel penyusun inti atom yaitu proton dan neutron. Jumlah proton akan selalu khas untuk setiap unsur dan bilangan/angka yang menunjukkan banyaknya proton disebut nomor atom.
Jumlah proton dan neutron dalam sebuah atom yang berada dalam inti atom, menjadi penentu massa atom khas setiap unsur dan bilangannya. Hal ini disebut sebagai nomor massa.
Itulah penjelasan mengenai struktur atom dan sejarah perkembangan ilmu pengetahuan yang mendasarinya. Semoga bermanfaat.
Baca juga: Isomer: Pengertian, Jenis, dan Contohnya |
(khq/inf)


























































