Tabel periodik adalah tabel yang menampilkan setiap unsur kimia dalam setiap sistemnya. Total, tabel periodik memiliki 118 unsur.
Unsur-unsur kimia dalam tabel periodik sangat beragam dengan sifat yang berbeda satu dengan yang lain. Tujuan dibuatnya tabel periodik unsur kimia adalah untuk mengenal nama unsur dari partikel kimia secara mudah melalui pengelompokan.
Kemudian tabel periodik unsur berfungsi untuk membantu mengetahui nomor atom, konfigurasi elektron, dan mempelajari setiap sifat-sifat unsur serta keteraturannya.
SCROLL TO CONTINUE WITH CONTENT
Pada tabel sistem periodik, terdapat golongan dan periode. Golongan adalah baris vertikal pada sistem periodik. Sedangkan, periode terlihat sebagai baris horizontal.
Sejarah Sistem Periodik Unsur
Dalam buku Kimia oleh Nana Sutresna dijelaskan bahwa pada tahun 1913, Henry Moseley telah melakukan eksperimen pengukuran panjang gelombang unsur menggunakan sinar-X. Hasil dari eksperimen kimiawan Inggris itu adalah sifat dasar atau bukan tidak didasari oleh massa atom relatif, melainkan didasari oleh kenaikan jumlah protonnya.
Ikatan jumlah proton tersebut telah mencerminkan kenaikan nomor atom unsur. Sehingga, sifat-sifat unsur merupakan fungsi periodik dari nomor atomnya.
Pengelompokan unsur-unsur sistem periodik modern merupakan penyempurnaan hukum periodik Mendeleev yang disebut juga tabel periodik bentuk panjang. Jadi, penyusunan sistem periodik modern didasarkan pada kenaikan atom dan kemiripan sifatnya.
Gambar Tabel Periodik Unsur Kimia
Tabel periodik unsur kimia bisa detikers lihat di bawah ini.
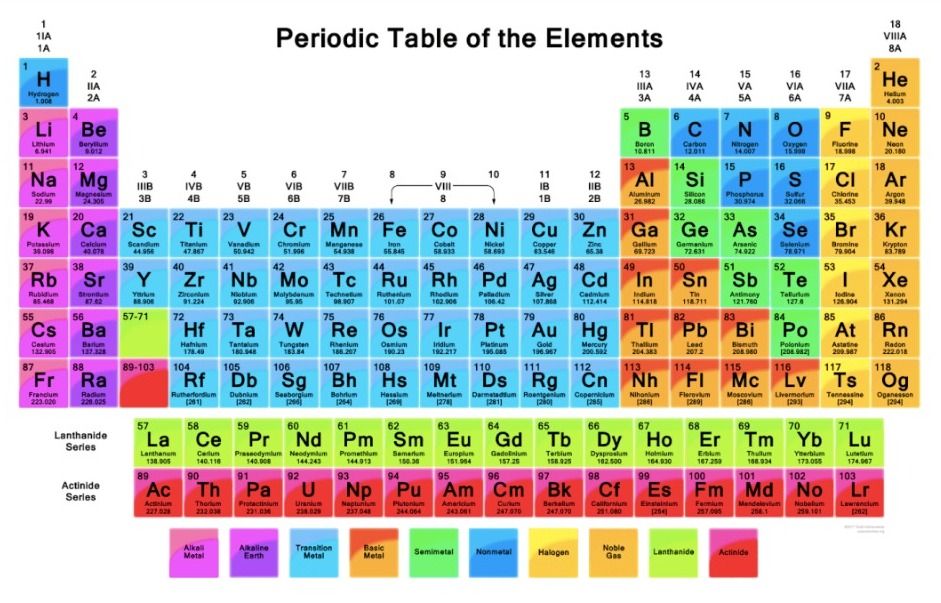 Gambar Tabel Periodik Unsur Kimia Foto: dok. modul belajar Kemdikbud Gambar Tabel Periodik Unsur Kimia Foto: dok. modul belajar Kemdikbud |
Sifat Keteraturan Tabel Periodik
Dalam tabel periodik, terdapat angka-angka dengan keteraturan sifat unsur berdasarkan jari-jari atom, keelektronegatifan, energi ionisasi, logam dan non-logam dan juga afinitas elektron. Agar mudah memahami tabel periodik, berikut penjelasan sifat-sifat tersebut.
1. Jari-jari Atom
Jari-jari atom adalah jarak dari inti atom sampai kulit terluar suatu atom. Secara periodik, jari-jari atom akan cenderung semakin besar dalam satu golongan dari atas ke bawah. Sebab, nomor atom bertambah seiring dengan kulit elektron dalam satu golongan.
2. Energi Ionisasi
Ionisasi adalah energi untuk melepaskan elektron yang terikat paling lemah oleh suatu atom atau ion dalam wujud gas. Secara periodik, energi ionisasi akan mengecil dalam satu periode, dari kiri ke kanan, energi ionisasi cenderung bertambah.
3. Afinitas Elektron
Afinitas elektron adalah besarnya energi yang dihasilkan atau dilepaskan pada suatu atom yang menarik sebuah elektron. Secara periodik, dalam satu golongan dari atas ke bawah, afinitas elektron cenderung mengecil dari kiri ke kanan sampai golongan VII A, dan cenderung bertambah kecuali unsur alkali tanah dan gas mulia.
Semua unsur golongan utama mempunyai afinitas elektron bertanda negatif, di mana unsur golongan terbesarnya dimiliki oleh golongan halogen. Semakin negatif nilai afinitas elektron, maka semakin besar kecenderungan atom atau ion menerima elektron.
4. Elektronegativitas
Elektronegativitas atau keelektronegatifan merupakan kecenderungan suatu atom menarik pasangan elektron dalam membentuk ikatan. Unsur yang memiliki energi ionisasi dan afinitas elektron yang besar, akan membuat keelektronegatifan semakin besar.
Secara periodik, dalam satu golongan, dari atas ke bawah, elektronegativitas cenderung akan semakin kecil, sedangkan dari kiri ke kanan dalam satu periode, cenderung semakin besar.
5. Logam dan Non-logam
Sifat logam dan non logam merupakan kecenderungan atom untuk melepas elektron dan membentuk ion bermuatan positif. Adapun sifat logam berkaitan dengan keelektropositifan. Semakin besar energi ionisasinya, maka sifat logamnya akan berkurang.
Sementara sifat non logam berkaitan dengan keelektronegatifan, yakni kecenderungan atom untuk menyerap elektron. Kecenderungannya melepas atau menarik suatu elektron disebut dengan kereaktifan.
Itulah penjelasan mengenai tabel periodik unsur kimia. Sudah paham, detikers?
(nir/pal)