Dalam ilmu fisika dan kimia, kita mengenal atom. Atom adalah unsur kimia terkecil yang dapat berdiri sendiri dan dapat bersenyawa dengan atom yang lain.
Salah satu teori yang terkenal dan masih digunakan hingga saat ini adalah Teori Atom Bohr. Simak sejarah, model, isi Teori Atom Bohr, serta kelebihan dan kekurangannya.
Sejarah Teori Atom Bohr
Sebelum muncul Teori Atom Bohr, sudah ada sejumlah teori tentang atom, salah satunya adalah yang dikemukakan Ernest Rutherford pada awal abad ke-20.
SCROLL TO CONTINUE WITH CONTENT
Dikutip dari situs uns.ac.id, Rutherford menemukan bahwa atom terdiri dari sebentuk awan difus elektron bermuatan negatif mengelilingi inti yang kecil, padat, dan bermuatan positif.
Fisikawan lalu membayangkan sebuah model sistem atom yang mirip dengan orbit planet yang mengelilingi matahari. Namun model sistem orbit planet untuk atom ini memiliki kelemahan.
Misalnya, hukum mekanika klasik (Newtonian) memprediksi elektron akan melepas radiasi elektromagnetik ketika sedang mengorbit inti. Pada proses pelepasan itu, elektron kehilangan energi sehingga lama-kelamaan akan jatuh secara spiral menuju ke inti. Frekuensi radiasi elektromagnetik yang dipancarkan kemudian akan berubah.
Akan tetapi percobaan pada akhir abad 19 menunjukkan loncatan bunga api listrik yang dilakukan dalam suatu gas bertekanan rendah di dalam sebuah tabung hampa akan membuat atom-atom gas memancarkan cahaya (yang berarti radiasi elektromagnetik) dalam frekuensi-frekuensi tetap yang diskret.
Pada tahun 1913, fisikawan berkebangsaan Swedia bernama Niels Bohr mengikuti jejak Einstein menerapkan teori kuantum untuk menerangkan hasil studinya mengenai spektrum atom hidrogen. Bohr memaparkan teori baru mengenai struktur dan sifat-sifat atom.
Teori Atom Bohr pada prinsipnya menggabungkan teori kuantum Planck dan teori atom dari Ernest Rutherford.
Bohr menyebut, apabila elektron dalam orbit atom menyerap suatu kuantum energi, elektron akan meloncat keluar menuju orbit yang lebih tinggi. Begitu pula sebaliknya, jika elektron tersebut memancarkan suatu kuantum energi, maka elektron akan jatuh ke orbit yang lebih dekat dengan inti atom.
Model Atom Bohr
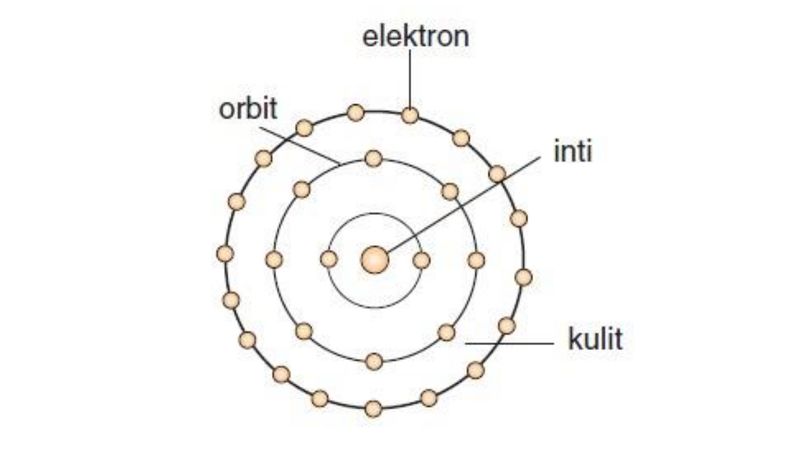 Gambar Model Atom Bohr. Foto: Modul Pembelajaran Kimia Kelas X: Perkembangan Model Atom, Kemdikbud Gambar Model Atom Bohr. Foto: Modul Pembelajaran Kimia Kelas X: Perkembangan Model Atom, Kemdikbud |
Dikutip dari Modul Pembelajaran Kimia Kelas X: Perkembangan Model Atom yang diterbitkan Kemdikbud, gambar model atom Bohr menunjukkan bahwa atom terdiri dari beberapa kulit elektron.
Kulit elektron adalah kedudukan elektron-elektron pada tingkat tertentu. Kulit ini menjadi tempat berpindahnya elektron.
Kesimpulannya, selama elektron-elektron berada di lintasan, energinya relatif tetap. Elektron-elektron yang berputar mengelilingi inti atom berada pada lintasan atau tingkat energi tertentu. Inilah yang dikenal sebagai kulit atom. Hal ini menjadi dasar untuk menentukan konfigurasi elektron suatu atom.
Isi Teori Atom Bohr
Berikut ini isi dari Teori Atom Bohr yang dilansir dari Jurnal Tadris Kimia IAIN Syekh Nurjati Cirebon Vol. 01 No. 01, Tahun 2022:
- Atom terdiri dari inti yang bermuatan positif dan di sekitarnya beredar elektron-elektron yang bermuatan negatif.
- Dalam atom, elektron beredar mengelilingi inti atom pada orbit tertentu yang dikenal sebagai keadaan gerakan yang stasioner. Selanjutnya ini disebut dengan tingkat energi utama atau bilangan kuantum atau kulit (n).
- Sepanjang elektron berada dalam lintasan stasioner, energi akan konstan, sehingga tidak ada cahaya yang dipancarkan.
- Elektron hanya dapat berpindah dari lintasan stasioner yang lebih rendah ke yang lebih tinggi jika menyerap energi. Dan sebaliknya, jika elektron berpindah dari lintasan stasioner yang tinggi ke yang rendah terjadi pembebasan energi.
Kelebihan dan Kelemahan Teori Atom Bohr
Berikut ini sejumlah kelebihan dan kekurangan Teori Atom Bohr:
Kelebihan Teori Atom Bohr
Dalam Buku Ajar Kimia 1 (2022) oleh Maris Kurniawati, dijelaskan beberapa kelebihan Teori Atom Bohr, yaitu:
- Teori ini mampu menjawab kelemahan dari Teori Atom Rutherford dengan mengaplikasikan teori kuantum.
- Mampu menerangkan dengan jelas tentang garis spektrum pancaran (emisi) atau serapan (absorpsi) dari atom hidrogen.
Kelemahan Teori Atom Bohr
Dikutip dari bahan ajar Fisika Paket C Kelas XII: Teori Atom dan Keterbatasan Sumber Energi terbitan Kemdikbud, Teori Atom Bohr memiliki kelemahan tidak dapat menjelaskan efek Zeeman dan efek Strack.
Model Atom Bohr ini tidak dapat menjelaskan semua perilaku elektron. Pada tahun 1920, Erwin Schrödinger mengusulkan bahwa elektron berjalan dalam bentuk gelombang, yang berarti posisi yang tepat dari mereka tidak dapat ditentukan.
Erwin Schrödinger mengembangkan suatu persamaan untuk menghitung kemungkinan elektron berada di setiap tempat tertentu. Memakai persamaan itu, ia mengidentifikasi daerah di sekitar inti yang disebut orbital sebagai tempat paling mungkin bagi elektron. Orbital merupakan dasar dari model awan elektron dari atom.
Itulah tadi penjelasan mengenai Teori Atom Bohr, mulai dari sejarah, model, isi teori, hingga kelebihan dan kelemahannya.
(bai/inf)


























































