Dalam mata pelajaran Kimia, ada pembahasan mengenai larutan. Larutan merupakan sebuah campuran dari zat pelarut dan terlarut. Konsentrasi larutan bisa ditentukan melalui berbagai cara. Salah satu caranya adalah dengan melakukan titrasi.
Titrasi dibagi menjadi 3 yaitu titrasi asam basa, pengendapan, dan redoks. Titrasi asam biasa biasanya dilakukan pada laboratorium menggunakan alat dan bahan yang sudah ditentukan.
Sebelum melakukan eksperimen di laboratorium, ada baiknya mengetahui terlebih dulu apa itu titrasi asam basa, jenis titrasi asam basa, prosedur, dan bagaimana rumusnya. Simak penjelasannya di bawah ini.
SCROLL TO CONTINUE WITH CONTENT
Pengertian Titrasi Asam Basa
Dikutip melalui buku berjudul Mudah dan Aktif Belajar Kimia ditulis oleh Yayan dan Agus (2007), titrasi asam basa adalah suatu metode yang digunakan untuk menentukan konsentrasi dari zat dalam larutan. Larutan yang memiliki sifat asam akan dititrasi dengan larutan basa yang sudah diketahui konsentrasinya. Reaksinya dilakukan bertahap yakni tetes demi tetes hingga mencapai titik setara atau stoikiometri.
Dalam titrasi asam basa, zat yang bereaksi pada umumnya tidak berwarna, sehingga sulit untuk mengetahui kapan titik stoikiometri tercapai. Contohnya larutan HCL dan NaOH, keduanya tidak berwarna, setelah bereaksi juga tetap tidak berwarna.
Jenis-jenis Titrasi Asam Basa
Ada dua jenis titrasi asam basa berdasarkan pada jenis zat terlarut dan larutan standarnya, yakni asidimetri dan alkalimetri. Berikut ini penjelasannya dikutip melalui buku berjudul Kimia SMA Kelas IX ditulis oleh Muchtaridi dan Sandri (2007).
Titrasi Asidimetri
Titrasi asidimetri adalah penentuan konsentrasi larutan basa dengan menggunakan larutan asam. Titrasi jenis ini menggunakan asam sebagai larutan standar. Larutan asam kuat jika dititrasi dengan basa kuat, akan menghasilkan pH yang netral.
Namun, apabila larutan asam kuat dititrasi dengan basa lemah, maka akan menghasilkan pH kurang dari 7 dan bersifat asam. Contohnya larutan amonium hidroksida (NH4OH) yang merupakan basa lemah dititrasi dengan asam klorida (HCL) yang merupakan asam kuat.
Titrasi Alkalimetri
Titrasi alkalimetri adalah penentuan konsentrasi larutan asam dengan menggunakan larutan basa. Titrasi jenis ini menggunakan basa kuat sebagai larutan standar. Apabila larutan basa kuat dititrasi dengan larutan asam kuat, maka akan menghasilkan reaksi pH yang netral.
Namun, apabila larutan basa kuat dititrasi dengan larutan asam lemah, maka akan menghasilkan reaksi pH lebih dari 7 dan bersifat basa. Contohnya reaksi yang terjadi antara HCL dengan NaOH.
Prosedur Titrasi Asam Basa
Ketika hendak melakukan titrasi asam basa, ada baiknya mengetahui apa saja prosedur yang dibutuhkan. Untuk melakukan titrasi dibutuhkan sebuah alat berupa buret dan labu Erlenmeyer. Selain itu, titrasi juga memerlukan analit, titran, serta indikator asam basa. Berikut ini penjelasannya:
- Analit adalah larutan yang belum diketahui konsentrasinya
- Titran adalah larutan standar yang sudah diketahui berapa konsentrasinya
- Indikator asam basa adalah zat yang bisa mengalami perubahan warna apabila mendekati titik ekivalen.
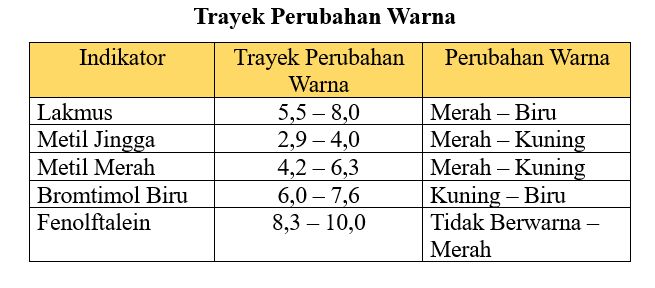 Foto: Rindang Krisnawati/detikcom Foto: Rindang Krisnawati/detikcom |
Setelah semua alat dan bahan yang dibutuhkan sudah tersedia, maka langkah selanjutnya adalah memperhatikan prosedurnya.
- Masukkan titran ke dalam buret
- Kemudian, masukkan analit ke dalam labu Erlenmeyer
- Selanjutnya tambahkan beberapa tetes indikator asam basa ke dalam analit yang ada di labu Erlenmeyer
- Teteskan sedikit demi sedikit larutan titran ke dalam analit
- Berhenti melakukan titrasi apabila sudah ada perubahan warna pada analit.
Rumus Titrasi Asam Basa
Untuk menghitung titrasi, gunakan rumus berikut ini yang dikutip melalui buku berjudul Cepat Kuasai Rumus Kimia ditulis oleh Nuryanto (2016).
Ma x Va x a = Mb x Vb x b
Keterangan:
Ma = konsentrasi atau molaritas asam
Mb = konsentrasi atau molaritas basa
Va = volume asam
Vb = volume basa
a = valensi larutan asam
b = valensi larutan basa
Contoh soal titrasi asam basa:
Berikut ini merupakan data hasil titrasi dari larutan HCL dengan larutan Ba(OH)₂ 0,1 M:
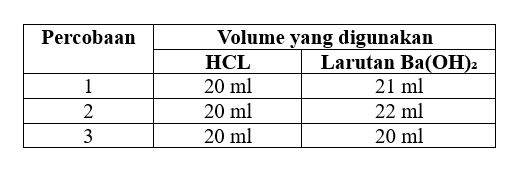 Foto: Rindang Krisnawati/detikcom Foto: Rindang Krisnawati/detikcom |
Maka, konsentrasi larutan HCL adalah?
Pembahasan:
Sebelum menentukan konsentrasinya, coba tentukan volume rata-rata dari Ba(OH)₂ yang digunakan:
V Ba(OH)₂ rata-rata = 21 + 22 + 20 / 3
= 63 / 3
= 21 ml
Selanjutnya tentukan konsentrasinya:
Ma x Va x a = Mb x Vb x b
Ma x 20 x 1 = 0,1 x Vb x 2
Ma = 0,1 x 21 x 2 / 20 x 1
Ma = 4,2 / 20
Ma = 0,21 M
Itulah penjelasan mengenai titrasi asam basa yang bisa kami sampaikan. Semoga bermanfaat!
(fds/fds)


























































