Molaritas adalah salah satu satuan dari konsentrasi larutan secara kuantitatif. Dalam hal ini, banyaknya zat terlarut di dalam larutan disebut konsentrasi.
Dari berbagai bentuk konsentrasi, molaritas memiliki banyak pengaruh pada sifat koligatif larutan.
Supaya detikers lebih paham, kenali pengertian molaritas dalam bidang kimia, rumus, contoh soal hingga jawabannya di bawah ini.
SCROLL TO CONTINUE WITH CONTENT
Pengertian dan Rumus Molaritas
Dikutip dari modul Guru Pembelajar IPA Terapan Kemdikbud yang disusun oleh Euis Siskaningrum, molaritas adalah jumlah mol zat terlarut dalam satu liter larutan.
Molaritas dinyatakan dengan lambang M. Satuan dari molaritas adalah mol/liter atau molar (M).
Molaritas sama dengan jumlah mol zat terlarut dibagi dengan volume larutan dalam liter. Dengan demikian, molaritas bisa diartikan oleh persamaan M = molaritas = mol zat terlarut/ liter larutan.
Secara sistematis, rumus molaritas larutan adalah sebagai berikut:
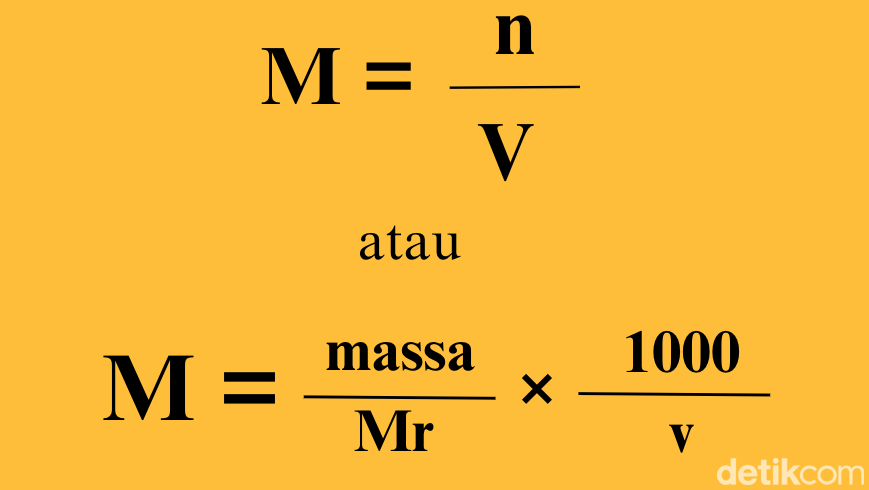 Rumus molaritas. Foto: Kholida Qotrunnada/detikcom Rumus molaritas. Foto: Kholida Qotrunnada/detikcom |
Keterangan:
M = molaritas (mol/L)
n = mol zat terlarut (mol)
V = volume larutan (Liter)
Mr = massa molekul relatif
v = volume larutan (mL)
Di mana, mol zat terlarut bisa dihitung dengan membagi massa zat terlarut (dalam gram) dengan massa rumus relatif zat terlarut.
Contoh Soal Rumus Molaritas dan Jawabannya
Kita bisa menghitung molaritas menggunakan persamaan rumus yang telah disebutkan sebelumnya. Perhatikan contoh soal molaritas dan jawabannya di berikut ini.
Contoh Soal 1
Ada sebanyak 10 gram NaOH (Mr = 40) yang dilarutkan dalam air hingga volume 500 mL. Berapa hitunglah molaritas-nya?
Jawaban Penyelesaian
Diketahui:
Massa zat terlarut (NaOH) = 10 gram
Mr NaOH = 40 mL
Volume larutan: 500 mL
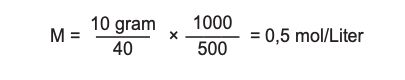 Pembahasan soal menghitung molaritas. Foto: Foto: tangkapan layar dok. Modul Kemdikbud Kimia Pekat C Setara SMA/MA Pembahasan soal menghitung molaritas. Foto: Foto: tangkapan layar dok. Modul Kemdikbud Kimia Pekat C Setara SMA/MA |
Contoh Soal 2
Diketahui suatu larutan 500 mL mengandung 0,730 mol. Berapa molaritas larutan tersebut?
Jawab:
M = mol zat terlarut/ liter larutan
= 0,730 mol / 0,500 L
= 1,46 mol/L atau 1,46 M
Contoh Soal 3
Diketahui 4 gram NaOH (Ar Na = 23, O = 16, H = 1) dilarutkan ke air hingga volume larutan mencapai 250 ml. Tentukan molaritas larutan tersebut!
Jawab
M = massa/Mr x 1000/v
= 4/40 x 1000/250
= 0,4 M
Jadi, didapatkan bahwa molaritas larutan tersebut adalah 0,4 M atau 0,4 mol/L.
Contoh Soal 4
Ada suatu larutan dibuat dengan menggunakan 15 g natrium sulfat, dengan volume larutan 125 mL. Hitung molaritas larutan natrium sulfat tersebut.
Larutan:
Rumus molekul natrium sulfat yaitu Na2SO4.
Rumus molekul air adalah H2O.
Massa molekul natrium sulfat dihitung dengan:
M=23×2+32+16×4=142
Artinya, jumlah mol natrium sulfat dalam soal yang diberikan dihitung dengan:
n = 15/142
= 0,106
Volume larutannya adalah 125 ml, jika dinyatakan dalam satuan liter menjadi 0,125 L.
Maka, cara mencari molaritas jika diketahui volume-nya adalah sebagai berikut:
M = 0,106/0,125
= 0,85
Jadi, molaritas larutannya yaitu 0,85 M.
Itu tadi penjelasan mengenai molaritas yang menggambarkan hubungan antara mol zat terlarut dan volume larutan, beserta rumus molaritas lengkap dengan pembahasan soalnya.
(khq/inf)


























































